巧用反證法解決化學(xué)計(jì)算問題
◇ 江蘇 曹正樺
?
巧用反證法解決化學(xué)計(jì)算問題
◇江蘇曹正樺
反證法常用于數(shù)學(xué)計(jì)算中,是指通過假設(shè)某命題不成立,并證明該命題與已知結(jié)論相悖,間接說明假設(shè)命題錯(cuò)誤,從而推出原命題成立.在高中化學(xué)平衡、混合物辨析等知識(shí)考查中,利用反證思想可以達(dá)到出奇制勝的效果.本文將通過實(shí)例對(duì)反證法的使用進(jìn)行討論,提高學(xué)生的辨析能力和思維轉(zhuǎn)換能力.
1 混合物計(jì)算中的反證法應(yīng)用
混合物的計(jì)算因?yàn)榻M分眾多,對(duì)各組分的定量往往是不全面的.若是采用傳統(tǒng)的計(jì)算方法,由于缺乏對(duì)應(yīng)的組分條件,很難求解.此時(shí),不妨利用反證法,用演繹推理的方法,將混合物中的對(duì)應(yīng)組分求解出來.


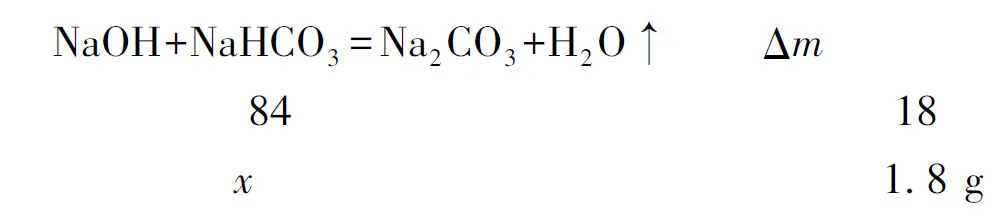
通過上述的對(duì)應(yīng)關(guān)系,可快速求出x=8.4g,故NaOH的質(zhì)量分?jǐn)?shù)為54.4%.
2 氧化還原反應(yīng)中的反證法應(yīng)用
氧化還原反應(yīng)是高中化學(xué)的重要考點(diǎn),對(duì)氧化性與還原性強(qiáng)弱的判斷是很多學(xué)生學(xué)習(xí)的弱項(xiàng).在氧化還原反應(yīng)中,氧化劑的氧化性總是強(qiáng)于氧化產(chǎn)物,還原劑的還原性總是強(qiáng)于還原產(chǎn)物.若是能夠?qū)ρ趸瘎⑦€原劑的強(qiáng)弱性質(zhì)進(jìn)行準(zhǔn)確判斷,對(duì)學(xué)生書寫氧化還原反應(yīng)必然事半功倍.

A3Cl2+6FeI2=2FeCl3+4FeI3;
BCl2+FeI2=FeCl2+I2;
CCo2O3+6HCl=2CoCl2+Cl2↑+3H2O;
D2Fe3++2I-=2Fe2++I2

3 離子反應(yīng)中的反證法應(yīng)用

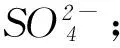
C丙溶液中含有Cl-;D丁溶液中含有Mg2+

江蘇省鹽城市鹽阜中學(xué))

